扫一扫,关注我们
微信公众号:武汉得创净化设备有限公司
发布时间:2021-03-29 23:09 人气: 来源:http://www.whwccj.com
 ,
,
 , 本标准了无菌医疗器具以及零部件生产与质量控制的基本上规定。, 无菌医疗器具初包装制品的生产也应合乎本规范的要求。,
, 本标准了无菌医疗器具以及零部件生产与质量控制的基本上规定。, 无菌医疗器具初包装制品的生产也应合乎本规范的要求。,
 ,
,
YY 0033-2000无菌检测医疗器材生产制造管理制度
我国医疗行业规范
无菌检测医疗器材生产制造管理制度
Good manufacture practice for sterile medical devices


本标准了无菌检测医疗器材以及零部件生产制造与质量控制的基本上规定。
无菌检测医疗器材初包装制品的生产制造也应合乎本规范的要求。
以下规范所包括的条款。根据在本规范中引入而组成为本规范的条款。本规范出版发行时,所显示版本号均为合理。全部规范都是会被修定,应用本规范的多方应讨论应用以下规范最新版的概率。
GB/T6583--1994 质量控制和品质保证 专业术语
GB/TI6292--1996 医药业洁净室(区)飘浮颗粒的测试标准
GB/T 16293--1996 医药业洁净室(区)落菌的测试标准
GB/TI6294--1996医药业洁净室(区)沉降菌的测试标准
YY/T 0313--1998 医疗高分子材料产品包裝、标示、运送和存储
JGJ 71--1990洁净室工程施工及施工验收规范
本规范应用GB/T 6583与YY/T 0313的界定和以下界定。
3.1批lot
生产制造标准相对性平稳时需生产制造的具备同一特性和质盘的某类商品明确的总数。
3.2生产批号lot number
用以鉴别“批”的一组数据或英文字母加数据,由此追朔和核查该批商品的生产制造历史时间。
3.3生产制造批production lot
指在一段时间内,同一加工工艺标准下持续生产出的具备同一特性和品质的商品明确的总数。
注:对有一些持续生产的商品。有时候难以区划生产制造批,出自于管理方法的必须,常以每一工作中日或车次生产制造出的商品做为生产制造批。
3.4杀菌批 sterilization lot
在同一灭菌柜内。同一加工工艺标准下杀菌的具备同样无菌检测确保水准的商品明确的总数。
3.5杀菌sterilization
用以使商品无一切方式的生存微生物菌种的确定过的全过程。
3.6无菌检测sterile
医疗器材上无生存微生物菌种。
3.7初包裝 primary package
与无菌检测医疗器材直接接触的包裝。
3.8无菌检测医疗器材sterile medical device
就是指一切标出了“无菌检测”的医疗机械。
3.9净化室(区)clean room(area)
必须对细颗粒物及微生物菌种含盘开展操纵的屋子(地区)。其建筑构造、武器装备以及功效均具备降低对该屋子(地区)内污染物的干预、造成和停留的作用。
3。10洁净度等级cleanliness
清洁自然环境内企业容积空气中含大于或等于某一粒度的飘浮颗粒的容许统计分析数。
3.11 空气过滤air purification
除去空气中的环境污染化学物质,使气体清洁的个人行为。
3.12 工作人员净化处理窒 personnel purification room
工作人员在进到净化室(区)前按一定程序流程开展净化处理的輔助专室。
3.13原材料净化处理室material purification room
原材料在进到净化室(区)前按一定程序流程开展净化处理的輔助专室。
3.14原材料material
指原材料、辅材,包装制品、购入(协)零配件等。
无菌检测医疗器材制造业企业应创建和执行合理的品质体系管理,产生一套详细的品质体系管理文档,并按时开展管理评审和内部审计。
注1lGB/T 19001与YY/T 0287或GB/T 19002与YY/T 0288要求了品质体系管理的规定。
4.1质量目标
质盈战略方针应由公司的最离管理人员以文档的方式施行,应保证 在有关职责和层级上创建质位总体目标及对质量目标的了解与执行。
4.2组织架构
4.2.1 公司应创建与质豫舒理管理体系和商品生产制造规定互通应的组织架构,要求其职责和内在联系(包含岗位职责和管理权限)并产生文档,以推动合理的质鼓管理方法。
4.2.2。公司最大管理人员应在管理者中特定一名或多位管理者代表,并要求其岗位职责和管理权限。
4.三人员
4.3.1 公司应配置与无菌检测医疗器材生产制造相一致的具备专业技能、生产制造工作经验、组织协调能力及了解相关法律法规医疗机械监管要求的各个、备类管理者和专业技术人员。承担机构生产制造和品质管理方面。
4.3.2公司最大管理人员务必蕾桃商品质盈?了解商品生产工艺,有组织协调能力,有一定的科学研究文化知识,能按本规范的规定机构生产制造,并对本规范的执行和产品品质负所有义务。
4.3.3公司负责人无菌检测医疗器材生产工艺和质量控制的领导人员应具备本技术专业或有关技术专业专科之上或与之非常的文凭,有无菌检测医疗器材生产制造相品质管理的实践工作经验,并对本规范的执行和产品品质承担。
4.3.4公司企业生产管理和质量控制单位的责任人应具备与做好本职工作相一致的专业技能和管理心得。有工作能力对无菌检测医疗器材生产制造和质量控制中的具体难题作出恰当分辨和解决。
无菌检测医疗器材企业生产管理单位和品质单位的责任人不可相互之间担任。
4.3.5从业重要职位和独特全过程的实际操作工作人员和产品质量检验工作人员应具备普通高中本科以上学历,经技术专业专业技术培训,具备基础知识专业知识和具体专业技能;职业检测工作人员,还应历经适度专业技术培训,井执证上岗。
4.3。6一般生产制造实际操作工作人员应具备与做好本职工作相一致的学历,经技术专业专业技术培训后入岗。
4.3.7。公司应依照本规范的规定对各种工作人员开展商品生产工艺、清洁自然环境操纵和医疗服务专业知识及商品运送、存储、安全防护等方而的学习培训和考评,持续提升 其业务水平和质量意识。并储存培训记录。
4.3.8 供货和市场销售单位应配器具备专业技能。并能担任无菌检测医疗器材供应和管理方面的工作人员。
5.1 生产地及工业区
无菌检测医疗器材制造业企业务必有干净整洁的工作环境。工业区的路面、地面及运送等不解决无菌检测医疗器材的生产制造导致环境污染。
5.1.1 生产地应挑选在卫生状况好,新鲜空气、空气烟尘、古菌浓度值低、无有害物质、地理环境好的地域。
5.1.2生产地应避开铁路线、港口、飞机场、交通干道及其释放大盈烟尘和有害物质的加工厂、贮仓、堆放场等比较严重环境污染、水体环境污染、震动或噪音影响的地区。净化车间与市政工程交通出行于道中间的间距不适合低于50 m。
5.1.3厂区域内关键路面应宽敝,地面整平,并挑选不容易起灰的原材料修建。
5.1.4工业区应合理布局。行政区域、宿舍区和輔助区不可对厂区有负面影响。小动物房和杀菌生产车间应建在清静安全性部位,并应该有相对的安全性、自然通风和污水处理(毒)设备,其设计方案修建应合乎相关法律法规要求。
5.1.5生产制造工业厂房周田应做到四无(无存水、无野草、无废弃物、无蚊虫蚊蝇滋生)。宜无外露土地资源。
5.2生产制造工业厂房
生产制造工业厂房按生产工艺流程和产品品质规定分成一般厂区和洁净区。工业厂房应按生产制造生产流程及所规定的气体洁净度等级等级开展布局调整。
5.2.1一般厂区
一般厂区应设计方案有效,光照、自然通风优良,可以达到生产制造必须。
5.2.2洁净区
5.2.2.1除达到5.2.1条外。还应配备与洁净度等级等级相一致的空调系统净化设备。附则A得出了无菌检测医疗器材净化室(区)气体洁净度等级等级。附则B得出了无菌检测医疗器材商品工作环境洁净度等级等级的设定手册。
5.2.2.2在设计方案、基本建设和室内装修净化车间时,应考虑到其便于清理。净化室(区)的内表层应整平、光洁、无缝隙,插口严实,无细颗粒物掉下来,能承受清理和消毒杀菌,。墙面与路面的交汇处宜制成弧型或选用别的对策,以降低尘土堆积和便于清理。并有防污、污染治理、避免 虫类和别的小动物及脏东西渗入等设备。
5.2.2.三人员净化处理室、净化室(区)的窗扇应选用两层窗,并具备优良的密闭性。净化室(区)的顶篷及进到净化室(区)内的管路、出风口与墙面或顶篷的位置均应密封性。
5.2.2.4净化室(区)的门应密封性优良,并向洁净度等级高的方位打开。
5.2.2.5净化室(区)应设立防护门。并向安全疏散方位打开,平常密封性优良,应急时便于开启,安全出口应无障。
5.2.2.6净化室(区)内要按生产流程布局调整,人工流产、货运物流分离并固定不动迈向。
5.2.2.7净化室(区)内的水,电等运输路线宜暗敷。电气设备管线管口,安裝于墙壁的各种各样电气设备与墙面接口处均应靠谱密封性。
5.2.2.8净化室(区)应取用外界造型设计简易、不容易积灰,便于擦洗的照明设备,照明设备宜明装不适合悬吊训练。选用吸顶安裝时。照明灯具与顶篷接口处应选用靠谱密封性对策。
5.2.2.9工作台应光洁、整平。无间隙、不掉下来细颗粒物和化学纤维,不积尘,便于清理、消毒杀菌,不能用木制或漆料橱柜台面。
5.2.2.10净化室(区)内应用的空气压缩等汽体均应历经净化处理解决。尤其是与商品应用表层点接触碰的汽体的洁净度等级应开展认证并开展基本操纵,以融入于所生产制造的商品。
5.2.2.11净化室(区)内的蓄水池、防臭地漏不可对无菌检测医疗器材造成环境污染。
5.三人员净化处理
5.3.1人员净化处理室应包含脱鞋室、存外套室、洗漱间,穿沽净工作服装室、气闸室或气体吹淋室等。
5.3.2进到无菌检测医疗器材生产制造净化室(区)或无菌操作原则净化室(区)的工作人员应开展净化处理。附则D得出了出入净化室(区)的一般程序流程。
5.3.3进入工作人员净化处理地区的脱鞋处,留意二种鞋不必交叉式环境污染。出门鞋和即将换的鞋应该有显著不容易随便超越的界线。在清洁窒(区)内不可穿凉拖。
5.3.4人员流动性应严格执行从低洁净度等级地区向高洁净度等级地区方位流动性。
5.3.5洗漱间自来水龙头按较大 班总数每10人物关系一个,水龙头启闭宜不选用手拉式。
5.3.6气闸室的进出门应该有避免 另外开启的对策。设定單人气体吹淋室时,应按较大 班总数每30人物关系一台,净化室(区)工作员超出五人时,气体吹淋室一侧应设单边旁通阀门。
5.3.7。净化室(区)工作员平均总面积应不少于4 m2。
5.4原材料净化处理
5.4.1进到清洁厂区的原材料等应该有清理对策,如脱外包装盒室、除灰室等。
5.4.2原材料净化处理室与净化室(区)中间应设定气闸室或两层不锈钢传递窗,用以传送原材料和其他物件。
5.4.3原材料运送、存储的外包装盒及易掉下来烟尘和化学纤维的包装制品不可进到净化室(区)。直接接触商品的初包装制品在运送、存储和传送中理应能合理避免 环境污染,最少双层密封性包裝。
5.5加工工艺合理布局
5.5.1 净化车间内要按商品产生全过程顾向布局,生产流程紧凑型、有效,原材料传送线路尽可能要短,以利于实际操作和过程管理,人工流产、货运物流遵守交通法规,严苛分离,严禁交叉式往复式。
5.5.2净化室(区)只有设定必需的加工工艺武器装备和设备,应该有与生产规模相一致的室内空间储放净化室(区)内生产制造的正中间商品或商品,且尽量挨近两者之间相联络的生产制造地区,降低运送全过程中的掺杂与环境污染。储放地区内要分配待验区、达标区和不过关区,有显著标志。
5.5.3气体洁净度等级高的净化室(区)宜布局在工作人员至少历经或抵达的地区,不一样洁净度等级等级的净化室(区)按从高到低由里及外布局。不一样等级净化室(区)中间互相联络应该有避免 环境污染对策,如气闸室或两层不锈钢传递窗。
5.5.4不一样气体洁净度等级地区中间的原材料传送如选用输送带时,为避免 交叉式环境污染,输送带不适合穿越重生隔断墙,宜在隔断墙两边按段传输。
对不能杀菌商品厂区中,不一样气体洁净度等级地区中间的原材料传送,则务必按段传输,除非是传送装置选用持续消毒方式。
5.5.5需要在洁净室(区)内清洗的器材,其清理室的气体洁净度等级等级应与商品规定相一致。100级、10 000级洁净室(区)的设备及器材宜在本地区外清洗,其清洗室的气体洁净度等级不可小于100 000级。
5.5.6清洁用具清洗、干躁及卫浴洁具储放宜设单独的环境卫生且自然通风优良的沽具间。卫浴洁具不可储放在洁净室(区)内。
6.1设备的设计方案、型号选择应合乎生产制造规定,合理布局,便于实际操作、检修和维护保养。
6.2洁净室(区)内采用的设备与工作服应具备肪尘、污染治理对策,其构造简易、噪音低、运行没发尘。设备、工作服与管路表层应光滑、整平、不可有颗粒物化学物质掉下来,便于清洗和消毒杀菌或杀菌,能降低环境污染。
6.3与物料或商品直接接触的设备与工作服及管路表层应无毒性、抗腐蚀、无死角,并便于清洗和消毒杀菌或杀菌、不与物料或商品产生化学变化与黏连。
6.4设备常用的润滑液、冷却液、清洗剂及在清洁区域内根据模貝成形后不清洗的零配件常用的脱膜剂,都不可对商品导致环境污染。
6.5应设定单独的模貝间(或地区),用以模貝的维护保养和储放,以避免 模貝对浩挣室(区)的环境污染。
6.6应配置充足总数的工装夹具,并且密闭性好,便于清洗和消毒杀菌。洁净室(区)内与一般厂区的工作中器材要严苛分离、有显著标识,不可交叉式应用。
6.7应具备制取加工工艺用水的设备,水处理的工作能力应达到生产制造必须;加工工艺用水应按规范按时检验;加工工艺用水的储存罐和运输管路应以不锈钢板或别的无毒性原材料;应按时清洗、消毒杀菌。
6.8用以生产制造和检测的仪器设备、仪表盘、测量仪器、电子衡器等的应用领域和精密度应合乎生产制造和产品质量检验的规定,应有显著的情况标志,并按照规定的周期时间开展计量检定或校检。
6.9设备和工作服应按时开展维护保养、维护保养和认证。设备升级时,应予以认证,明确对产品品质无危害时方能应用,参照附则E。
6.10生产制造、检测设备(包含备用品、配件)工作服及工装夹具的管理方法应有要求,并应创建设备档案资料,储存设备应用、维护保养、检修和改善纪录。
7.1公司应有要求操纵购置全过程,定编购置文档如采购方案、合同书、技术性合同书等,明确指出购置物料的质最规定,以保证 其符合规定要求,并保存购置文档的团本。
7.2解决供应商开展点评,对其工作环境(尤其是有净化处理规定时)、品质保证、是不是有符合我国要求的证件、信誉度等开展调研、剖析。在大批订购前先开展小量使用,检测达标后才可用以生产制造。供应商应相对性平稳。应创建并储存供应商的品质纪录。
7.3购置物料入厂后应放到有显著“待验”标示的地区,经质量检验单位检测达标后才能申请办理进库办理手续。
7.4物料应储放在溫度、空气湿度合乎分别规定并无腐蚀汽体、自然通风优良、有消防安全对策的库房内,待验品、合格品、特采应严苛分离,有情况标志,能合理的避免 互用。各种物料归类、分次存储,填好储位卡。
7.5物料派发应有纪录并有发、领料单人的签字,物料派发应遵照先进先出法的标准。(全文连接:http://www.iwuchen.com/a-942/)
7.6标识、合格证书、使用手册、小袋装应由专职人员存放,其派发、应用、消毁应有纪录。
7.7易燃性、易燃易爆物料应有独特隔离措施。
8.1质量管理体系文档
8.1.1公司应定编叙述其品质体系管理的质量管理手册。
8.1.2公司应定编本规范所规定的体系文件、管理资料和要求,并合理地贯彻落实。
注l:GB/T 19001与YY/T 0287或GB/T 19002与YY/T 0288要求了对品质体系管理文档的规定。
8.2技术性文档
公司应有具体指导商品生产制造和应用的技术性文档,技术性文档应统一、详细、恰当。
8.3文档的操纵
8.3.1公司应定编文档管理程序,与品质相关的全部文档(包含质量管理手册、体系文件、标准、样图、规范、工艺文件或安全操作规程等)都需要开展操纵。公布前要准许,应用的文档应以合理版本号,应按照规定开展改动;最少储存一份废止的受控文件,其储存限期应保证 在无菌检测医疗器材的使用寿命期限内,能够获得此器材的生产制造标准,。
8.3.2做为品质纪录的文档应制订书面形式程序流程开展操纵,要求品质纪录的标志、存储、查找、维护、保质期和处理。品质纪录的储存限期应不少于医疗器材的使用寿命,但最少不短于2年。
9.1公司应设最大管理人员立即领导干部下的质量控制单位,质量控制单位的责任人应合乎4.3.4条规定。
9.2质量控制单位应配置一定总数的质量控制和检测工作人员,并有与无菌检测医疗器材生产规模、种类、检测规定相一致的物理学、有机化学、实验室和测试仪器设备。
9.3质量控制单位的岗位职责和管理权限:
a)承担无菌检测医疗器材生产制造整个过程的质量控制和检测工作中。依据产品执行标准和品质规定制订检测标准;
b)有权利准许或否定一切物料及正中间商品的应用和商品原厂;
c)决策包装制品、标识、使用手册是不是容许应用;
d)点评物料、正中间商品、商品的存储标准是不是可用;
e)对商品开展备用观查,定期检验,以点评商品的品质可靠性,也为明确商品的有效期限出示根据;
f)审批特采程序处理和改正、防范措施程序流程;决策对退还、取回和不合格产品的解决方法;
g)承担检测和实验用设备、仪器设备、实验试剂及计量检定的管理方法;
h)承担洁净室(区)与加工工艺用水的检测和纪录。
9.4质量控制单位应按照规定开展拿货检测或认证、全过程检测、商品最后检测。并出示检测纪录和汇报;纪录和/或汇报中应有实行检测和受权商品海关放行责任人的签名。
9.5质量控制单位应按照规定开展取样,取样应有象征性。
9.6质量控制单位应会与相关部门对供应商开展点评。
10.1 公司解决商品产生的所有生产过程开展操纵。
10.2商品宣布建成投产前,应开展生产工艺流程的全方位认证,明确加工工艺的可行性分析。
10.3独特全过程和重要工艺流程应设定质最基准点,应制订基准点管理资料和工作具体指导文档(如工艺卡或安全操作规程等),开展持续的监控和操纵,对全部主要参数开展纪录。
10.4依据商品对工作环境洁净度等级的不一样规定,各种各样操作流程只仅限于在特定的生产制造地区开展。进到洁净室(区)的工作人员和物件务必按相对商品规定的工作人员和物料的净化处理程序流程开展净化处理。不一样洁净度等级地区内的工作中器材的传送和应用应避免 交叉式环境污染。
10.5在洁净室(区)内储放的生产过程中的正中间商品,应有避免 环境污染的对策。并有产品名和检测情况标志,对不过关的正中间商品应独立储放、纪录,以避免 互用。
10.6针对需清洗的零配件,末道清洗应在相对等级的洁净室(区)上用相对规定的加工工艺用水开展清洗。清洗用水及清洗全过程应历经确定并开展基本操纵,以融入所生产制造的商品。
10.7商品标志和追朔性
10.7.1无菌检测医疗器材制造业企业应要求在生产制造的整个过程应用适合的方式标志商品。每次或每一个商品在产生全过程中应有清楚、坚固的唯一性标志并搞好纪录,保证 具备追朔性。
10.7.2公司应制订生产批号(生产日期和杀菌生产批号)管理方法的操纵文档,每次或每一个商品均应有体现商品鉴别及所投物料、生产过程(包含洁净室(区)环保监测、重要工艺流程及独特全过程如杀菌主要参数等)。的操纵状况、相关设备应用、生产制造日期,实际操作工作人员与核查工作人员签字和检测結果的品质纪录。
10.8包裝、标示、标识与使用手册
10.8.1 无菌检测医疗器材务必选用密封性包裝,包装制品应依据商品特性和灭菌方法选料和设计方案,并应合乎存储规定。
注;ISO/DIS11607要求了点评无菌检测诊疗器坎包裝特性的基本上规定。
10.8.2无菌检测医疗器材的无菌检测包裝的较大 模块应以单包裝,单包裝应该标明“无菌检测”字眼和/或符号,应有“包裝损坏严禁应用”字眼。
10.8.3包裝上的标示应能恰当具体指导商品的运送、存储、解包和应用,而且显著、清楚、坚固,不因承受常用的杀菌、运送和存储全过程而掉下来或模模糊糊。
10.8.4 包裝上的标示內容务必合乎相对产品执行标准的规定。
10.9杀菌
10.9.1必须杀菌的无菌检测医疔器材应取用一确定过的灭菌方法开展灭酶,以保证 杀菌实际效果的稳定性。
注:适合的灭菌方法和医疗机械杀菌全过程的确定与基本操纵规定见IS0 11131,IS011135、IS0 11137。
10.9.2杀菌前与杀菌后的商品应严苛分离,应有标志,并与检测达标的商品严苛区别起来。
10.9.3实际操作工作人员应严苛依照文档要求开展杀菌实际操作,并有详细的杀菌全过程及主要参数纪录。
10.10特采的操纵
10.10.1 公司应制订特采操纵的体系文件,以避免 特采的非预估应用或交货。
10.10.2对特采。应开展标志、备案、点评、防护和处理。
10.10.3特采仅有在达到政策法规规定的状况下才可以妥协接受;如要返修应确定返修对商品的不好危害,返修后应按照规定开展再次检测并开展纪录。
10.11 改正和防范措施
10.11.1 公司应制订和执行改正与防范措施的体系文件。
10.11.2公司应有效解决消费者举报和不过关汇报;调研与商品生产过程和品质体系管理相关的不过关造成的缘故;采用纠正措施并开展认证。
10.11.3公司应运用各种各样信息内容来源于,发觉和剖析不过关的潜在性要素,采用防范措施并执行操纵。
10.11.4公司对消费者举报沒有采用改正和防止措施的,应记录其理由。
公司应制订与产品品质规定和生产工艺流程相一致的卫生管理文档,并认真落实、搞好记录。
11.1 净化室(区)环境卫生
11.1.1 应按文档要求对净化室(区)开展按时清理、清理和消毒杀菌,常用的消毒液或消毒方法不可对机器设备、工作服、原材料和商品导致环境污染。消毒液的种类应按时拆换。
11.1.2应按时依照附则C的规定对净化室(区)开展检测、记录。
11.2个人环境卫生
11.2.1公司应制订实际操作工作人员环境卫生准则,內容应包含常常剪发、冼澡、修指甲、禁止画妆、禁止配戴饰品、禁止将本人物件带人净化室(区)等:并有专职人员查验。
11.2.2公司应创建员工健康档案,直接接触原材料和商品的实际操作工作人员每一年最少应常规体检一次,对身患感染性和传染性疾病的工作人员不可从业直接接触商品的工怍。
11.2.3进到净化室(区)的工作人员务必按相对商品规定的工作人员净化处理程序流程开展净化处理。并配戴洁净服、工帽、防护口罩、劳保鞋。直接接触商品的实际操作工作人员每过一定時间敌人再开展一次消毒杀菌。
11.3加工工艺环境卫生
11.3.1机器设备、管路应按时清理、维持干净整洁,无跑、冒、滴、漏状况。
11.3.2机器设备、工作服上与商品直接接触的位置及工作中橱柜台面、工装夹具应按时清理、消毒杀菌,维持清洁。净化室(区)内的工装夹具应在净化室(区)上用纯水系统开展清理,消毒杀菌。
11.3.3洁净服应挑选材质光洁、不造成静电感应、不掉下来化学纤维和颗粒物性化学物质的原材料制做。其工作服装和遮阳帽应能合理地遮住內衣、秀发。不一样洁净度等级等级应用的洁净服皮各自按时集中化在相对等级的清洁自然环境中清理、干躁、梳理。
11.3.4 净化室(区)仅限该地区生产制造实际操作和经准许的工作人员进到。
12.1公司应创建客户档案资料,常常与客户联络,积极征询用户反馈,立即向客户出示服务项目。
12.2每次商品都应该有市场销售记录,一旦发觉不过关能马上讨回,记录应最少保存到有效期限后一年。
12.3对客户举报能妥善处理,对销售全过程的信息内容应能及时反馈到相关工作部门,采取一定的有效措施,并有记录。
12.4公司成创建医疗器材不良反应汇报规章制度,特定主管机关或工作人员部门管理。对不良反应应立即向本地药物监管单位汇报。
12.5创建商品事故调查报告规章制度和商品讨回规章制度。无菌检测医疗器材发生重特大产品质量问题时,应立即向本地药物监管单位汇报。因备用观查或我国抽样检查,发觉已原厂的商品存有不过关,应该马上讨回,并按特采管理程序开展解决。
(规范的附则)
无菌检测医疗器材净化室(区)气体洁净度等级等级表
表A1
| |
浮尘较大 容许数,个1┫ |
微生物菌种较大 容许数 |
||
| 洁净度等级等级 |
≥0.5 um |
≥5 um |
沉降菌,个/皿 |
落菌,个/m3 |
| 100级 |
3 500 |
0 |
l |
5 |
| 10 000级 |
350 000 |
2 000 |
3 |
100 |
| 100000级 |
3 500 000 |
20 000 |
10 |
500 |
| 300 000级 |
10500 000 |
≤60 000 |
15 |
―― |
(规范的附则)
无菌检测医疗器材商品工作环境洁净度等级等级设定手册
B1 无菌检测医疗器材应选用使环境污染降至最低值的生产工艺。在考虑到工作环境的洁净度等级等级时,应与生产工艺融合起來。当生产工艺不可以确保医疗器材应用表层不会受到环境污染或不可以合理清除环境污染时,工作环境的洁净度等级应在标准批准的前提条件下,尽盘提升 。
B2净化室(区)内有好几个工艺流程时,应依据各工艺流程的不一样规定,选用不一样的气体洁净度等级等级,在达到生产工艺流程规定的标准下,净化室(区)的自然通风可选用部分工作区域空气过滤和整屋空气过滤紧密结合的方式,如10 000下的部分100级洁净区。
B3针对身体假体、与循环系统血夜、骨腔立即或间接接触的无菌检测医疗器材或单包裝原厂的零配件,其零部件(不清理件)的生产加工、末道清理、拼装、初包裝以及密封等生产制造地区应不低予100 000级洁净度等级等级。嵌入到毛细血管内的无菌检测医疗器材、能在某一部分自然环境下完成生产制造、安装、包裝整个过程的无菌检测医疗器材,应在不少于10 000级(优先选择采用100级)净化室(区)内生产制造。
B4 B3要求之外的无菌检测医疗器材或单包裝原厂的零部件(不清理件)的生产加工、末道精细洗、拼装、初包裝以及密封均应在不少于300 000级净化室(区)内开展。
B5与商品的应用表层直接接触、不清理即应用的商品初包裝,其生产制造工业厂房的洁净度等级等级应与商品生产制造工业厂房的洁净度等级等级同样(尽量在同一地区),如初见包裝不与商品应用表层直接接触,优先选择考虑到在不少于300 000净化室(区)内生产制造。
B6针对选用无菌操作原则技术性生产加工的身体植人无菌检测医疗器材(包含原材料),应在10 000级下的部分100级净化室(区)内开展生产制造。
B7洁净服清理、干躁和穿洁净服室、专用型工装夹具的末道清理与消毒杀菌地区的气体洁净度等级等级可小于厂区一个等级。无菌检测工作服装的梳理、杀菌后的存储应在10 000级净化室(区)内。
(规范的附则)
无菌检测医疗器材净化室(区)自然环境规定及监铡
表C1
| |
性能指标 |
|
|
||||
| 检测新项目 |
100级 |
10 000级 |
100000级 |
300000级 |
检测方式 |
检测次数 |
|
| 溫度,℃ |
(无特别要求时)18-28 |
|
1次/班 |
||||
| 空气湿度,% |
45―65 |
1次/班 |
|||||
| 风力。m/s |
水准层.流 ≥0.4 竖直层汽 ≥0.3 |
―― |
―― |
―― |
JGJ 71--1990 |
1次/月 |
|
| 换风,次/h |
―― |
≥20 |
≥15 |
≥12 |
1次/月 |
||
| 负压差,Pa |
不一样等级洁净室(区)及洁净室(区) 和非洁净室(区)中间≥5 |
1次/月 |
|||||
| 洁净室(区)与户外空气≥10 |
|||||||
| 浮尘数 |
≥0.5 um |
≤3500 |
≤350 000 |
≤3500 000 |
≤10 600 000 |
|
|
| 个/m3 |
≥5 pm |
0 |
≤2 000 |
≤20 000 |
≤60 000 |
GB/TI6292--1996 |
1次/季 |
| 落菌数,个/m3 |
≤5 |
lOO |
500 |
|
GB/T16293--1996 |
1次/季 |
|
| 沉降菌数,个/皿 |
≤l |
≤3 |
≤10 |
≤l5 |
GB/T16294--1996 |
1次/周 |
|
表明:
无菌检测医疗器材洁净室(区)在静态数据标准下检验的浮尘数、落菌数或沉降菌数、换风(100级层.流风力)、负压差、溫度、空气湿度务必符合要求,应按检测次数对以上主要参数开展动态性检测。
(提醒的附则)
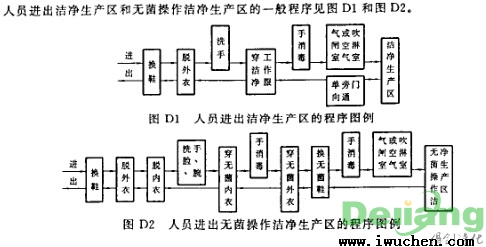
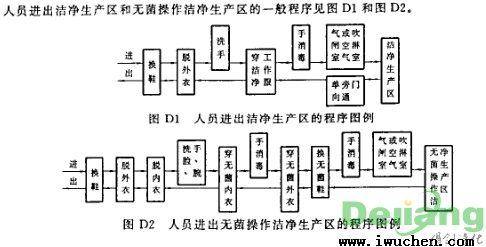
工作人员出入清洁厂区的一般程序流程
工作人员出入清洁厂区和无菌操作原则清洁厂区的一般程序流程见图D1和图D2。
(提醒的附则)
认证与确定
E1无菌检测医疗器材资金投入生产制造前解决净化车间、关键设备、机器设备、工作服及加工工艺开展认证或确定。
E2 当危害商品的关键要素,如加工工艺、工作服、质量管理方式、关键原辅材料、关键生产线设备发生改变时,及其生产制造一定周期时间后,应开展再次认证或确定。
E3应依据认证或确定目标明确提出认证或确定新项目、制订认证或确定计划方案,并组织实施。
E4认证或确定工作中进行后应后应产生文档。认证或确定文档应包含认证或确定计划方案、认证或确定汇报、点评和提议、准许人等。
E5认证或确定过程中所产生的文档应存档储存。
E6无菌检测医疗器材生产制造中认证或确定的新项目包含(但不限于):
a)空气过滤系统软件;
b)关键生产线设备;
c)重要生产工艺流程、工作服以及变动;
d)关键原料采购变动;
e)加工工艺自来水系统软件及末道清理加工工艺(如果有);
f)加工工艺用空气压缩或其他汽体(如果有);
g)杀菌设备和全过程(如果有)。
(提醒的附则)
参考文献文件目录
[1] GB/T 19001--199.1 质量管理体系 设计方案、开发设计、生产制造、安裝和服务项目的品质保证方式
[2]GB/T 19002--1994 质量管理体系 生产制造、安裝和服务项目的品质保证方式
[3]YY/T0287--1996 质量管理体系 医疗机械GB/T 19001--IS0 9001运用的专用型规定
[4] YY/T 0288--1996质量管理体系 医疗机械GB/T 19003--IS0 9002运用的专用型规定
[5] IS011134;1994 保健医疗商品的杀菌――确定和基本操纵规定――工业生产湿热灭菌
[6] ISOl1135:1994 医疗机械――环氧乙烷杀菌的确定和基本操纵
[7] IS0 11137:1995 保健医疗商品的杀菌一一确定和基本操纵规定――辐射源杀菌
[8] ISO/DIS 11607:1999医疗机械最后杀菌包裝
文章内容来源于:http://www.iwuchen.com/